人工遺伝子デリバリーシステムなどの薬物送達システム(DDS)の構築
天然ポリアミンの医用材料への応用
天然の生理活性物質をモチーフにした類縁体の合成とその生理活性に関する研究
人工遺伝子デリバリーシステムなどの薬物送達システム(DDS)の構築
天然ポリアミンの医用材料への応用
天然の生理活性物質をモチーフにした類縁体の合成とその生理活性に関する研究

マルチファンクショナル非ウイルスベクター
高効率で細胞傷害性の低い非ウイルスベクタ−の開発を目指しています。
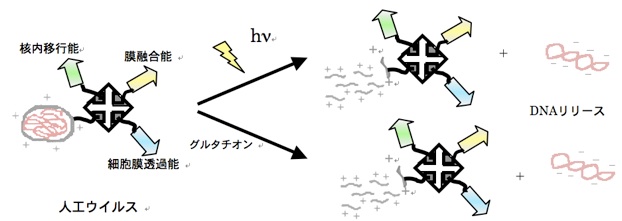
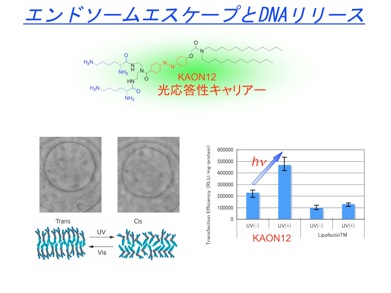
光応答性非ウイルスベクター
アゾベンゼンを基体とするカチオン脂質はトランスーシス光異性化によりベシクル膜の揺らぎが増大します。DNA複合体がエンドソームに存在する際に光異性化を誘起すると、DNAはカチオン脂質と解離し、輸送小胞膜を破壊し、DNAの細胞質への脱出が促進され、最終的にはタンパクの発現が向上することを見出しています。
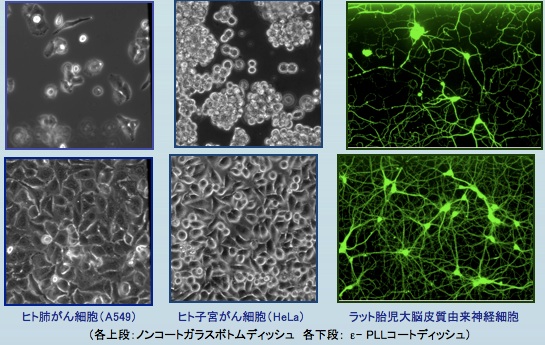
細胞培養基材用コーティング剤
微生物由来の ε-ポリ-L-リジン( ε-PLL)などを利用してガラスやプラスチック基材・三次元細胞足場への動物細胞接着性を向上させるコーティング剤の開発を目指しています。 ε-PLL は α-PLLやポリエチレンイミン(PEI)等と比較し、細胞毒性が低く、高い細胞親和性を示すことを見出しています。
天然ポリアミンを基体とする遺伝子キャリアー
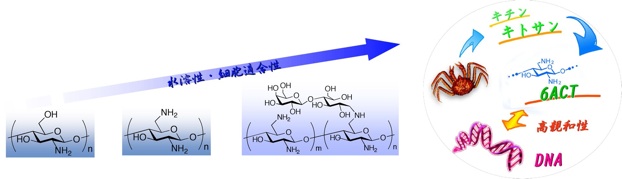
非ウイルスベクターの安全性を高めるために、生分解性や生体適合性に優れた天然素材である多糖類やぺプチド類を基体とした遺伝子キャリアーの構築を目指しています。
カニ甲羅由来ポリアミンであるキトサンの遺伝子キャリアーとしての機能を向上させるために、アミノ基密度を増大させた 6-アミノ-6-デオキシキトサン(6ACT)を新規に合成しました。 6ACTはキトサンよりも優れた遺伝子導入効率を示します。
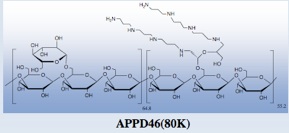
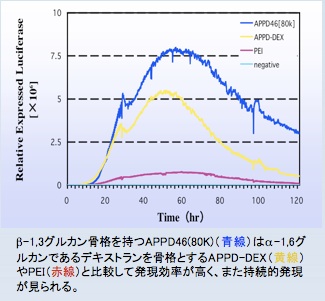
β-1,3グルカンであるシゾフィランの側鎖にオリゴアミンを導入した化合物(APPD46(80k))はβ-1,3グルカン骨格の安定性を反映し、長期間にわたる持続的発現用遺伝子キャリアーとして有効であることを見出しました。
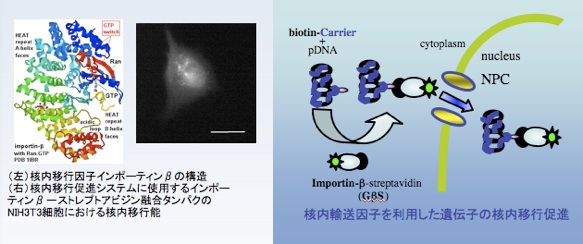
核内移行性核酸構造体
細胞質-核間の物質輸送の核内移行において主役をなす核内移行因子(インポーティンβ)を利用することで、外部遺伝子の細胞質からの核内移行を、更には遺伝子発現効率を促進することを目的としてます。
ガン細胞を細胞死(アポトーシス)へと導く低分子化合物の合成とその機構の解明
細胞は増殖と死のプロセスをいくつももっており、特定の刺激によりそれらが開始されます。正常ならばそのバランスは保たれていますが、増殖のシグナルがオンになったままであったり、死のプロセスが壊れていたりするとガン細胞となり無限に増殖してしまいます。
死のプロセスの1つにセラミドと呼ばれる脂質の一種が細胞内で関与していることが知られています。細胞外からの死のシグナルに応答して細胞内でセラミドが増え、ミトコンドリアにシグナルが伝わり、ミトコンドリアから細胞質へのシトクロムcの放出が起こります。その後、幾つかのステップを経てアポトーシスの実行因子と呼ばれるカスパーゼ-3の活性化が起こり、アポトーシスが誘導されます。しかしながら、セラミドがどのようにしてミトコンドリアに作用するのかはわかっていません。
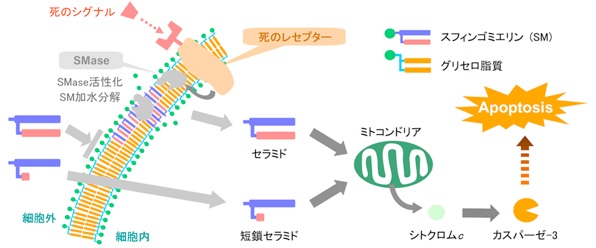
一般的にセラミドの研究では細胞膜透過性の高い短鎖セラミドが用いられており、細胞外から直接投与しても細胞をアポトーシスへと誘導することができます。そのため、抗ガン剤のモチーフとして研究が進められています。
アプローチ:
これまでに短鎖セラミドの構造をいろいろ変えたものを合成し、ガン細胞に対してアポトーシス効果があるかどうかを検討してきました(図2)。その結果、ヒト白血病由来HL-60細胞に対して図3に示した3-ケトセラミドが通常のセラミドに比べ、20~30倍のアポトーシス誘導効果があることがわかりました。また、セラミドと同様ミトコンドリアからのシトクロムc放出も確認しました。3-ケトセラミドはセラミドの酸化物でもあり、またどちらも酸化-還元反応場であるミトコンドリアに作用していることから、これまで未解明であったセラミドのミトコンドリアへの作用機構の解明に役立つと考えられます。
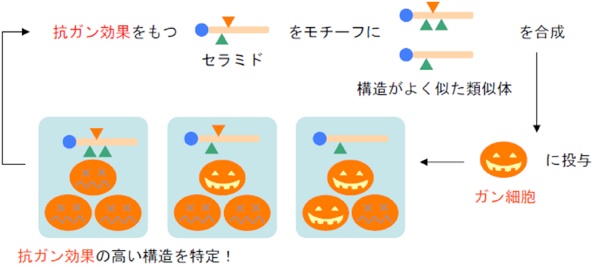
図2. 研究の流れ
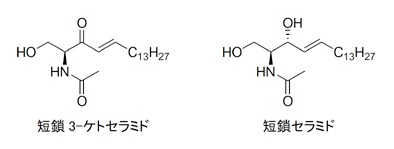
図3. 短鎖3-ケトセラミドとセラミドの構造
また、3-ケトセラミドはHL-60細胞以外のガン細胞、例えばヒト子宮頚ガン由来HeLa 細胞に対してもセラミドよりもはるかに高い活性を示すことが確認されており、抗ガン剤としての利用も期待できます。